
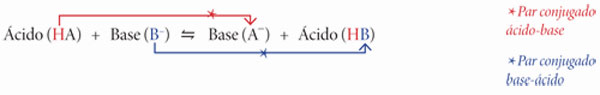
En 1923, tanto el químico y físico danés Johannes N. Brönsted (1879-1947) como el químico inglés Thomas M. Lowry (1874-1936) propusieron, al mismo tiempo pero de manera independiente, una nueva forma de definir a los ácidos y las bases. Considerando este modelo, los ácidos conservaron su definición de acuerdo con la propuesta de Arrhenius, como sustancias que donan protones (H+), mientras las bases fueron definidas como sustancias que aceptan protones. Cuando un ácido cede su protón, la especie química que se forma como resultado de este proceso es la base conjugada del ácido, denominado también par conjugado ácido-base. En el caso de una sustancia básica, si ésta acepta un protón se produce el ácido conjugado de la base, existiendo de esta forma el par conjugado base-ácido, como se representa en la siguiente ecuación química, en donde también puede apreciarse la transferencia del protón:
Con la propuesta de este modelo fue posible explicar las propiedades básicas de algunas sustancias, como por ejemplo el amoniaco (NH3), que de acuerdo con su estructura no cumple con el modelo de Arrhenius; en el caso de esta sustancia, las moléculas de amoniaco (base de Brönsted-Lowry) aceptan protones de las moléculas del agua (ácido de Brönsted-Lowry), produciendo iones amonio (ácido conjugado) e iones hidróxido en el medio (base conjugada), como se muestra en la siguiente ecuación:

La doble flecha en ambas direcciones representa que este proceso es reversible, es decir que se lleva a cabo tanto de reactivos a productos como de productos a reactivos. Si se observa esta reacción en dirección contraria, el ión amonio (NH4 +) es la especie que dona el protón (H+) y el ión hidróxido el que lo acepta para formar nuevamente agua y amoniaco. En este proceso, y de acuerdo con la propuesta de este modelo, en ambas direcciones el agua tiene la doble propiedad de ser tanto ácido como base, por lo que también recibe el nombre de sustancia anfótera. Este tipo de sustancias pueden actuar como donadores y aceptores de protones, es decir que pueden comportarse como ácido o como base. Para ejemplificar el comportamiento básico del agua, puede ilustrarse el caso del ácido clorhídrico (HCl), cuando se disuelve en agua se representa mediante la siguiente ecuación:
Como puede apreciarse el protón (H+) es aceptado por el agua que actúa como base, formando el ión hidronio (H3O+), que es un protón H+ asociado a una molécula de agua.
De acuerdo con este modelo propuesto por Brönsted y Lowry —que se denomina modelo de Brönsted-Lowry—, el agua es una de las moléculas que puede comportarse como un donador o aceptor de protones, confiriéndole un comportamiento ácido o básico que depende de la sustancia con la que se enfrente; sin embargo, el agua por sí misma puede presentar esta característica, como se indica en la siguiente ecuación:
H2O(l) + H2O(l) —› H3O+(ac) + OH–(ac)
En una muestra de agua, los protones de los átomos de hidrógeno migran de manera continua por atracción electrostática entre las moléculas, dando lugar a la formación de iones hidronio e hidróxido en el medio y regresando consecutivamente a su estado inicial, lo que permite la conocida como auto-ionización del agua, y que se representa de la siguiente forma:
H2O ⇔ H+ + OH–
La cantidad de iones hidronio e hidróxido que se producen en una muestra de agua es muy pequeña, alrededor de 1x10-7 mol/L de cada especie, es decir:
[H+] = [OH–] = 1.0 × 10–7 M
Si se considera el producto de la concentración de ambas especies puede expresarse mediante la constante de la autoionización del agua (Kw), como se indica a continuación:
[H+] [OH–] = 1 × 10–14 = Kw
Esta expresión de la constante de autoionización del agua permite explicar que el producto de las concentraciones de los iones hidrógeno e hidróxido siempre será igual a 1 × 10–14, de tal manera que si la concentración de alguno de los dos iones aumenta entonces la concentración de la otra especie disminuirá manteniéndose el valor de la constante. Si en una muestra de agua se aumenta la concentración de iones hidrógeno por la adición de un ácido, la concentración de los iones hidróxido deberá disminuir, y de esta forma el valor de la Kw seguirá siendo igual a 1 × 10–14; si se adiciona una base disminuirá la concentración de iones hidrógeno como consecuencia del incremento de los iones hidróxido.
Cuando la concentración de cada uno de los iones (hidrógeno e hidróxido) en una sustancia es igual a 1.0 × 10–7 M, se dice que la disolución es neutra y a partir de este parámetro pueden tenerse los siguientes casos:
• Si la [H+] es mayor que [OH–], la disolución presenta un carácter ácido.
• Si la [OH–] es mayor que [H+], la disolución presenta un carácter básico.
En cualquiera de los casos anteriores el producto de las concentraciones de ambas especies será igual a 1 × 10–14. De esta forma la constante de ionización del agua se expresa como:
Kw= [H+][OH–] = 1×10–14
