La temperatura de ebullición de una sustancia liquida es aquella en la que pasa al estado gaseoso. Al igual que la temperatura de fusión, su valor depende, y mucho, de interacciones conocidas como intermoleculares. Estas interacciones, a su vez, dependen de la polaridad de las moléculas de la sustancia en cuestión. Existen sustancias polares (como el agua) y no polares (como la parafina). Para tener una idea de la polaridad de una sustancia a partir de la estructura de sus moléculas, he aquí algunas características que pueden identificarse:
• Cuando haya enlaces con hidrogeno, es decir X-H, si X es oxigeno, flúor, cloro, nitrógeno, entonces el enlace será polar; es decir, estos átomos atraerán mas a los electrones, por lo que tendrán a su alrededor una delta negativa.
• Si se tiene un enlace X-C, donde X es oxigeno, nitrógeno o cloro, el enlace también será polar.
• Si se trata de un enlace con átomos iguales, significa que el enlace no es polar.
Por ejemplo, la fórmula del etanol se muestra a continuación:

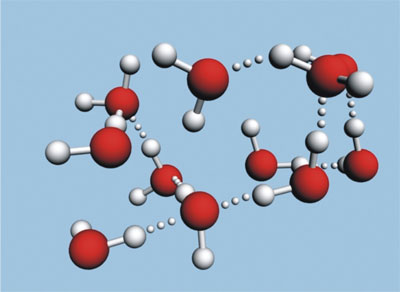
En la formula, la polaridad de la molécula está centrada en el enlace oxigeno-hidrogeno, pues el etanol también puede formar puentes de hidrogeno; sin embargo, la temperatura de ebullición del agua en condiciones normales de presión (1 atmosfera) es de 100 oC y la temperatura de ebullición del etanol es de 76 oC. Entonces la interacción puente de hidrogeno que forma el etanol no es tan fuerte como la del agua y se requiere menor energía para romperlo.
Otro ejemplo de interacciones entre dipolos o moléculas polares está en la acetona. Este líquido tiene la siguiente fórmula:
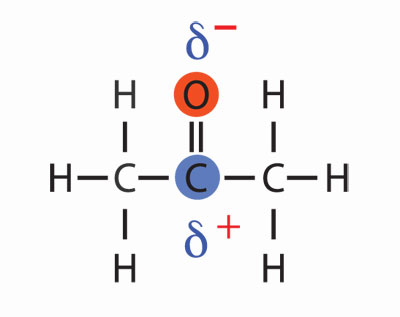
En este caso la polaridad de la molécula está centrada en los enlaces carbono-oxigeno (δ+C = Oδ–). Así, el oxigeno de una molécula puede interaccionar con el carbono de otra. Aunque estas interacciones son responsables de que las moléculas que forman la sustancia permanezcan unidas formando un líquido, también pueden ser bastante débiles. Al moverse las moléculas, estas uniones se rompen y vuelven a formarse continuamente. De ahí la fluidez de los líquidos.
Cuando las sustancias no son polares, la temperatura de ebullición está relacionada con la masa de las moléculas (véase el siguiente cuadro) y la interacción que mantiene unidas a las moléculas se conoce como dipolo inducido. Se le denomina así porque es un dipolo que solo se produce momentáneamente en la molécula y se crea debido a que los electrones no están fijos, sino en continuo movimiento. En un instante la posición aleatoria de los electrones puede generar un dipolo, y si justo en ese momento este se acerca lo suficiente a otra molécula, entonces el dipolo recién formado induce la formación de un nuevo dipolo en la molécula que se acerco, y así sucesivamente. Estos dipolos inducidos se conocen como fuerzas de dispersión o de London, en honor de Fritz London (1900-1954), un físico alemán que describió este tipo de interacciones.

