Se escucha con frecuencia que los metales son buenos conductores de la electricidad. Según la teoría electromagnética, para que exista flujo de electricidad en una sustancia debe también haber un movimiento de cargas positivas o negativas o de ambas. El movimiento de las cargas permite explicar el fenómeno de la conductividad eléctrica en los metales y también el tipo de interacción que existe en estas sustancias. La explicación más común es que los átomos que forman las sustancias metálicas se unen en una red cristalina compartiendo sus electrones de valencia. Esto ocurre entre muchos átomos. Los electrones de valencia en las sustancias metálicas pueden desplazarse sobre una red de millones de átomos y es esto lo que los caracteriza como buenos conductores de la electricidad. A este modelo se le conoce como "modelo de la nube electrónica". Cuando se coloca un metal en un paso de corriente eléctrica, la movilidad electrónica del metal permite que exista un flujo de electrones.
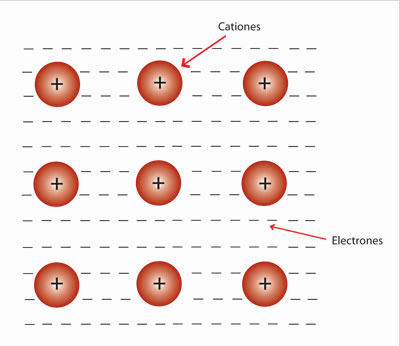
La conductividad eléctrica también permite explicar el modelo de iones para las redes iónicas, pues estas, a pesar de no conducir la electricidad cuando están en estado sólido, si lo hacen cuando se disuelven en agua. Por ejemplo, cuando el cloruro de sodio (NaCl) se disuelve en agua forma iones positivos (Na+) y negativos (Cl–). Al utilizar el conductímetro para determinar si a través de la disolución pasa la corriente eléctrica, los iones positivos son atraídos hacia el polo negativo del conductímetro y los negativos hacia el positivo. De esta forma se prueba que el modelo de aniones y cationes propuesto para las sustancias iónicas es válido.
Características especiales de los diamantes
Entre las sustancias que más han atraído la atención de la humanidad a lo largo de la historia está el diamante. Y no solo por su belleza y su rareza, pues existen piedras preciosas aun más raras que el diamante, sino también por sus características físicas y químicas.
A principios del siglo XIX Humphry Davy y Michael Faraday, dos prestigiados científicos de la época, se dieron el lujo de quemar varios diamantes en un horno, con el fin de determinar su composición y saber más acerca de ellos. Gracias a estos extravagantes estudios, actualmente se sabe que los diamantes están formados de átomos de carbono, los mismos que forman las puntas de los lápices y los trozos de carbón para quemar en el asador.
También se sabe que una de las propiedades del diamante es que es un buen conductor térmico, pero no un buen conductor eléctrico. Por ello la nanotecnología se está desarrollando en torno a esta sustancia con propiedades inigualables. Algo sumamente importante hoy en día es que ya empieza a hacerse química sobre la superficie del diamante, debido a que en ella los enlaces del núcleo de carbono son diferentes a los que están formando la red. Igual que cuando se teje una bufanda deben cerrarse los puntos con una doble puntada y el tejido queda diferente en la orilla que en el cuerpo de la bufanda, los núcleos de carbono que interaccionan para formar el diamante están enlazados a través de enlaces dobles y sencillos. Esto hace que estructuralmente sea muy fuerte, pero no evita que también puedan llevarse a cabo algunas reacciones químicas sobre su superficie.