En el siguiente cuadro se muestran las temperaturas de fusión de diversas sustancias solidas, algunas de ellas son elementales y otras son compuestas. Además, todas ellas se encuentran en estado sólido a temperatura y presión ambiente. Se observa que estos sólidos presentan temperaturas de fusión muy distinta, y para explicar estas diferencias es posible suponer modelos basados en las interacciones entre los átomos y los conjuntos de átomos que los conforman. Para sólidos con una temperatura de fusión alta es conveniente considerar que las interacciones entre los átomos que los conforman son fuertes y forman redes cristalinas. Así cada átomo esta interaccionando con muchos átomos, como en una red. Por ello se requiere una gran cantidad de energía para romper dichas interacciones. En cambio, sustancias como el azufre, la sacarosa o el acido esteárico, con temperatura de fusión baja (menor a 400 oC), se considera que presentan interacciones entre los conjuntos de átomos. Estas interacciones, además de ser menores en número, tienen menor energía, por lo que se rompen a bajas temperaturas.

Para explicar las propiedades de cada sustancia no basta con saber qué tipo de átomos la componen; hay que saber también la forma en que están unidos. Es importante asimismo reconocer que una muestra pequeña de cualquier sustancia (una gota de agua, la cabeza de un alfiler o un granito de sal) está formada de una cantidad enorme de átomos.
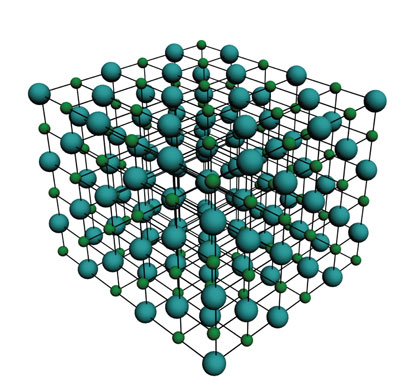
La sal de mesa, cuya temperatura de fusión es muy alta, se conoce con el nombre científico de cloruro de sodio. Esta sustancia está formada por iones cloruro (Cl–) y por iones sodio (Na+). La interacción entre los iones se explica utilizando una de las leyes de la física, según la cual las cargas contrarias se atraen y las iguales se repelen. Por eso se utiliza un modelo en el que se supone que cada ion positivo está rodeado de iones negativos y viceversa. Así, cada ion se une a varios de los que lo rodean y, a su vez, cada uno de ellos está unido a otros tantos, de tal forma que con la unión de miles y miles de millones de iones se construye una red cristalina bastante difícil de separar porque todos los iones están unidos entre sí. Esto explica la alta temperatura de fusión de la sal de mesa.
Como el cloruro de sodio, existen muchas otras sustancias con la propiedad de formar redes y por eso tienen temperaturas de fusión altas, mayores de 400 oC. Así, la formación de redes explica la temperatura de fusión alta, pero .por qué las sustancias que forman redes no se funden todas a la misma temperatura?
Hay de redes a redes, es decir, unas se funden a temperaturas más altas que otras. El tipo de interacción y el número de interacciones entre átomos, iones y moléculas explican que tan alta es la temperatura de fusión. En el diamante, por ejemplo, cada átomo de carbono esta unido a otros doce. Esta red le proporciona una gran dureza y altísima temperatura de fusión. En contraste, en el grafito cada átomo de carbono esta unido a otros tres y sus propiedades son diferentes de las del diamante. En condiciones extremas de altísimas o bajísimas temperaturas, cualquier sustancia puede hacerse solida, liquida o gaseosa, incluyendo el oro o el diamante, por ejemplo.
La interacción que mantiene unidos a los átomos se llama enlace. El enlace que mantiene unidos a cualquier par de átomos depende de los electrones de valencia de cada átomo, que son los más alejados del núcleo. Estos electrones determinan la capacidad de reacción de cada átomo y por este motivo dependen de ellos todas las propiedades químicas de las sustancias.

Los átomos permanecen unidos debido a que el núcleo positivo de un átomo atrae a los electrones negativos del otro átomo con el cual se une. En ocasiones extremas, esta atracción es tan fuerte que los electrones de valencia se transfieren de un átomo a otro, y se forma un anión (ion con carga negativa). El átomo con un electrón menos se queda como catión (ion con carga positiva). De esta forma se tienen iones positivos y negativos.
Uno de los modelos utilizados en física sirve para explicar la interacción de cargas y establece que las cargas iguales se repelen y las contrarias se atraen. Con los cationes y los aniones ocurre lo mismo porque se encuentran cargados. Los aniones repelen a los aniones, pero atraen a los cationes. Los cationes también se repelen entre sí. Así, la única forma de acomodamiento es que un anión se una con un catión. Cada catión estará rodeado por aniones y cada anión por cationes, con lo cual se va formando una red. Entre los casos extremos de este fenómeno, está el cloruro de sodio, donde los cationes (Na+) y aniones (Cl–) se acomodan en una inmensa red en la que cada ion cloruro se une a uno de sodio. Como esta red está formada de iones, se le conoce como de tipo iónico.
Una vez conocidas las causas de algunas propiedades como la temperatura de fusión y ebullición es posible explicar algunas de las diferencias entre sustancias como la sal y el azúcar. La sal es una sustancia que forma redes iónicas, en tanto el azúcar es una sustancia que no contiene iones. Aunque ninguna de las dos conduce corriente eléctrica en estado sólido y ambas son solubles en agua, solamente una de ellas conduce electricidad en disolución acuosa. Este fenómeno se explica con el modelo de las cargas en movimiento, con el cual es posible inferir el modelo de iones propuesto para sustancias como la sal. En el azúcar no hay iones y al no existir movimiento de cargas no puede conducirse la electricidad. Cuando se mide la conductividad de los cristales de sal resulta que no conduce, debido a que en el sólido los iones están unidos entre si y no pueden moverse. De esta manera, la conductividad eléctrica también proporciona información sobre la estructura interna de las sustancias.
