Hay miles y miles de sustancias en el mundo: naturales y artificiales, toxicas e inocuas. Se sabe que cada sustancia tiene ciertas propiedades, pero .de que depende esto?
Para responder a esta pregunta debe entenderse como y que tan fuertemente interaccionan los átomos que forman una sustancia, para que unas veces se mantengan unidos y otras no; además se debe analizar cómo y con qué fuerza interaccionan los átomos que forman una sustancia con los de otra sustancia, para que al ponerse en contacto se modifique su estructura.
De la forma en que interaccionan los átomos y las moléculas en las sustancias dependen propiedades como las temperaturas de fusión y ebullición, la solubilidad y la conductividad. Estas propiedades hacen únicas a las sustancias y les imponen características particulares.
A fin de comprender la estructura interna de las sustancias debe entenderse como están unidos los átomos que las forman. Lo más sencillo es analizar un modelo para explicar los estados de agregación de la materia. Para ello es importante tener presente que las sustancias pueden estar formadas de átomos iguales o diferentes.
Así pues, en un sólido los átomos o los conjuntos de átomos de la sustancia están lo bastante cerca unos de otros, y esta cercanía provoca que casi no puedan moverse, por el espacio tan reducido y las interacciones que suelen ser fuertes. Esta característica de los sólidos hace que tengan una forma definida. En un liquido los átomos o los conjuntos de átomos están más separados entre sí y pueden moverse más; por eso el liquido puede adoptar la forma del recipiente. En un gas los átomos o los conjuntos de átomos están muy separados unos de otros y pueden recorrer todo el volumen del recipiente que los contiene.
Una analogía para comprender lo anterior consiste en imaginar que en un cuarto completamente vacío se encuentran cinco personas. Cada una de ellas puede recorrer la habitación a sus anchas, su comportamiento es entonces semejante al de las sustancias en el estado gaseoso. Si el cuarto va llenándose de personas, llegara un momento en que ya no podrán moverse y solo podrán estar en un solo lugar, como las sustancias en el estado sólido.
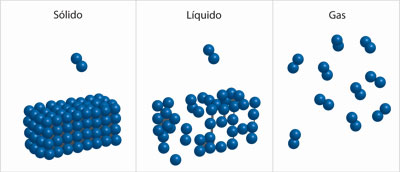
Las interacciones entre los átomos o conjuntos de átomos de una sustancia cambian en cada estado. En el gaseoso las interacciones entre ellos son muy débiles, porque están muy separados unos de otros. Por el contrario, en el sólido están muy cerca y las interacciones son fuertes. En el líquido las interacciones son menos fuertes que en el sólido, porque la distancia que separa a los átomos o al conjunto de átomos es intermedia entre el estado sólido y el gaseoso. También la temperatura influye en el movimiento de los átomos o de los conjuntos de átomos; cuando es más alta ellos se mueven a mayor velocidad.
En el modelo propuesto para entender los estados de agregación de la materia hay más interacciones y más fuertes en el líquido que en el gas. Si se consideran dos sustancias denominadas A y B, donde las interacciones en la sustancia A son más fuertes que en la sustancia B, y ambas están en estado liquido, la temperatura de ebullición del liquido A será mayor que la del liquido B, porque la temperatura a la que hierve un liquido depende de la magnitud de las interacciones entre los átomos o los conjuntos de átomos que lo forman.
Con este mismo modelo es posible explicar las diferencias entre las temperaturas de fusión de los sólidos, las cuales también tienen que ver con la magnitud de las interacciones entre los átomos o conjuntos de átomos que forman las sustancias.