Se tienen dos procesos que afectan la energía interna del agua, que la hacen cambiar en ΔU: por un lado, el calor Q = CΔt por la interacción con la flama que la aumenta y, por otro, el trabajo W = pΔV que el agua efectúa contra la atmósfera al dilatarse, que la disminuye. Ambos efectos se toman en consideración en la siguiente ecuación:
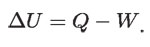
Esta ecuación, que gobierna los intercambios de energía de un objeto por calor y por trabajo, es la primera ley de la termodinámica. En realidad, la ecuación anterior es válida para cualquier otro objeto, sea sólido, líquido o gaseoso, de cualquier naturaleza, siempre y cuando sea un objeto mesoscópico. En particular, la ecuación se aplica para un fluido descrito por sus variables de volumen, presión y temperatura.
Puede ser, por ejemplo, vapor de agua o aire encerrado en un cilindro provisto de un pistón. En este caso, la presión interna del gas debe ser suficiente para generar una fuerza capaz de contrarrestar el peso del pistón y del aire por encima de él. El trabajo de expansión será nuevamente calculado por pΔV.
El signo negativo de W corresponde a la convención que asocia un signo positivo al trabajo cuando el sistema lo realiza sobre el exterior, y uno negativo en caso contrario; es decir, cuando un agente externo efectúa trabajo sobre el sistema.
En este caso, el agua al expandirse hace trabajo contra la atmósfera, por lo que W es positivo y, al restarse en la ecuación, significa que dicho trabajo se efectúa a expensas de su energía interna. Asimismo, Q se considera negativo si el sistema pierde energía interna por calor con otro objeto, y positivo si el sistema gana energía por calor de otro cuerpo.
Desde el punto de vista microscópico clásico, la energía interna U de todo sistema termodinámico, en particular del agua, se compone de términos asociados al movimiento de sus componentes moleculares, aunque también de los relacionados con la energía potencial de unas moléculas respecto a las otras.
Entonces, cuando U cambia, por calor o por trabajo, varían tanto la energía de movimiento de las moléculas (influyendo en el cambio de temperatura) como el valor promedio de la posición de ellas (cambio asociado, a su vez, con la variación del volumen del objeto).
En un gas monoatómico (formado por moléculas de un solo átomo), U se compone de la suma de las energías cinéticas 1/2 mνi 2, en donde m es la masa de la molécula y νi es la rapidez con que se mueve. En el agua, U consta de la energía cinética de las moléculas de H2O, sumada a la energía potencial asociada a las fuerzas intermoleculares.
Cuando un campo electromagnético de microondas hace vibrar a las moléculas de agua, es necesario sumar a U la energía asociada al movimiento vibratorio de las moléculas. El agua en una olla sobre una flama se calienta por transferencia de energía por calor.
Al hervir el agua, la temperatura de ebullición permanece constante, ya que la energía que la flama le proporciona por calor se invierte en romper los "amarres" de las moléculas del líquido. Las moléculas de agua escapan en forma de vapor, efectuando también trabajo expansivo en contra de la atmósfera; mientras quede líquido por evaporar, su temperatura se mantiene constante.
Ocurre también que la temperatura de ebullición depende de la altura sobre el nivel del mar. La presión del aire por encima de la olla impide el escape de las moléculas; como la capa de aire es menor en la ciudad de México que en Acapulco, el agua hervirá a una temperatura menor en la capital (94 °C) que en la costa (100 °C).
Si ahora se calienta agua en una olla cerrada (olla de presión), la presión aumenta dentro de ella, de modo que el agua alcanza temperaturas mayores a la de ebullición al aire libre. Si se logra mantener la temperatura alta, a fuego lento, dejando escapar un mínimo de vapor para que el recipiente no explote, se puede cocer un alimento en menos tiempo y empleando menos combustible que cocinando en una olla abierta.