Uno se puede imaginar que el cambio de temperatura de una alberca que se calienta con la misma flama, por tres minutos, es prácticamente de 0 °C, pero una pequeña cantidad de agua hasta puede hervir.
Entonces, para una cantidad de calor Q fija,
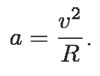
La propiedad que expresa el aumento de temperatura de una cierta cantidad m de sustancia, al incrementar su energía interna por una cantidad de calor Q, se llama capacidad térmica y se representa por la letra C. La capacidad térmica es proporcional a la cantidad de sustancia, que medimos por su masa m, es decir:
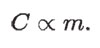
Si Q es fija,
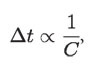
de modo que:
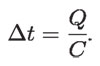
El aumento de temperatura de una sustancia por calor se sintetiza en la fórmula anterior, porque si una cantidad fija de sustancia se energiza por calor, o sea a C fija, el aumento de temperatura es proporcional a la cantidad de calor 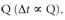 Es el caso de someter medio litro de agua a la acción de la flama por tres minutos y luego por seis.
Es el caso de someter medio litro de agua a la acción de la flama por tres minutos y luego por seis.
Si se energiza la sustancia por una cantidad fija de calor Q, el cambio de temperatura es inversamente proporcional a su masa ![]() . Es el caso en que medio litro de agua se pone sobre la flama por tres minutos, y luego un litro de agua se somete a la flama el mismo tiempo.
. Es el caso en que medio litro de agua se pone sobre la flama por tres minutos, y luego un litro de agua se somete a la flama el mismo tiempo.
Si se despeja C, quedará
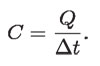
Las unidades de C son las de Q (joules, ya que el calor es energía), divididas entre las de Δt, que son grados Celsius; es decir:
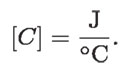
Ahora bien, si se aumenta la energía interna por calor de un kilogramo de agua y uno de mercurio, con la misma cantidad de calor Q, ¿qué sustancia aumentará más su temperatura?
En el experimento, tanto las masas como Q son los mismos, pero la temperatura a que llega el agua es mucho menor que la del mercurio. Por lo tanto, el cambio de temperatura depende de la naturaleza química de la sustancia.
Entonces, para comparar adecuadamente la respuesta térmica de una sustancia con otra ante una energización por calor, definimos una nueva capacidad térmica, que sea para la misma cantidad de masa:
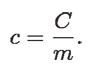
A c se le llama capacidad térmica específica, queriendo decir con específico que mide la respuesta térmica de una masa fija unitaria (un kilogramo) de dicha sustancia. La c depende, así, sólo de la naturaleza de la sustancia.
Las unidades de c son las mismas que las de C, pero divididas por la unidad de la masa que es 1 kg; es decir,
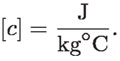
La capacidad térmica específica del agua es una de las más grandes; debido a esto, el aumento de su temperatura es menor que el de otras sustancias, cuando a masas iguales se les transfiere la misma cantidad de energía por calor. En la tabla siguiente se ofrecen datos comparativos de c:
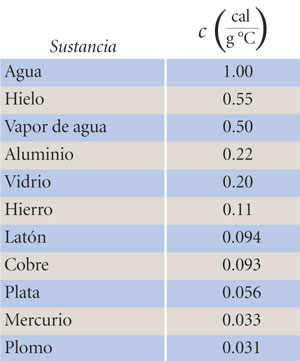
Las unidades en que está expresada c en la tabla anterior difieren de las empleadas en el SI; ello obedece a razones históricas que se explican a continuación.
La sustancia que se tomó como patrón para medir la cantidad de calor fue el agua, observando su incremento de temperatura ante una energización por calor conocida. El experimento es parecido al que se realiza en los laboratorios de las escuelas: en un vaso de material aislante se vierte una cierta cantidad de agua, a la temperatura de 14.5 ºC. Luego se sumerge en el agua un alambre por el que pasa una corriente, hasta que la temperatura del agua suba un grado Celsius (véase figura 11, p. 430).
El alambre se calienta con el paso de la corriente, subiendo su temperatura por arriba de la del agua. Esto ocasiona que el agua se energice por calor y, como consecuencia, eleve su temperatura.
Se dice que la cantidad de calor con que se energiza el agua es de 1 caloría, si la temperatura de 1 gramo de agua sube de 14.5 °C a 15.5 °C.
Para una masa de 1 gramo, se tendrá que la cantidad de calor involucrada es de:
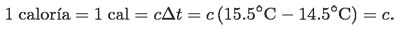
El valor de 1 cal, que coincide numéricamente con la capacidad térmica específica c del agua a 14.5 ºC, como se vio en la ecuación anterior, se calcula a partir de la energía eléctrica que circuló por el alambre.
Esta energía se mide en las unidades del SI y es de 4.185 joules, por lo que:
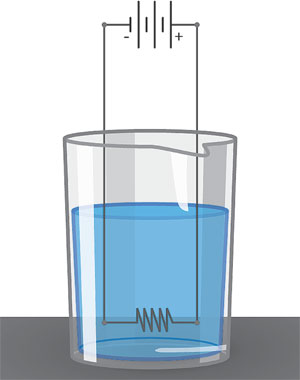
La cantidad de calor Q que calienta una masa m de agua, de 14.5 °C a 15.5 °C, será:
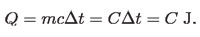
En calorías, el calor necesario para energizar una masa m' cualquiera de otra sustancia diferente del agua y elevar su temperatura en Δt, será de:
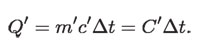
En la expresión anterior, las cantidades relativas a la otra sustancia se marcan con una prima. En el caso del experimento con un kilogramo de agua y uno de mercurio (es decir, m = 1 kg), el aumento de temperatura ante la energización por la misma cantidad de calor Q será:
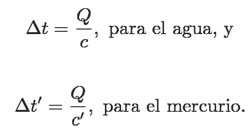
Como c > c', se sigue que Δt < Δt'; es decir, el mercurio "se calienta" más. La tabla anterior (p. 142) de c para diferentes sustancias muestra que:
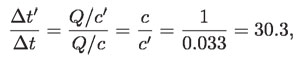
es decir, la masa de 1 kg de mercurio aumenta más de treinta veces su temperatura que la masa de 1 kg de agua, ante la misma cantidad de calor Q. Se dice, por semejanza con la masa mecánica, que el agua tiene mayor "inercia térmica" que el mercurio (y que muchas otras sustancias).
La relación cuantitativa entre las unidades en que se puede medir c se deduce de las siguientes relaciones:
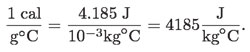
Empleando esta conversión es posible reescribir la tabla anterior en joule/kg°C, simplemente multiplicando los valores por 1 000.
Las sustancias son de dos clases: elementos y compuestos. Los elementos no pueden descomponerse en sustancias químicas más simples por métodos ordinarios de la química, pero sí un compuesto. En general, los elementos están formados por unidades estructurales microscópicas llamadas átomos, mientras que los compuestos están formados por unidades estructurales llamadas moléculas (que son agregados de átomos).
La cantidad de sustancia se determina especificando el número de unidades estructurales microscópicas; por ejemplo, en una muestra de hierro se puede especificar que hay 3.0 × 1024 átomos de Fe. En otro ejemplo, la cantidad de sustancia en un cristal de sal común, NaCl, contiene 7 × 1021 pares de iones Na+ Cl–.
En el SI, la unidad de cantidad de sustancia es el mol. El mol es la cantidad de átomos que hay en 12 gramos del isótopo carbono 12, que es igual a una cantidad constante llamada número de Avogadro, NA = 6.23 × 1023.
Un mol de moléculas de agua, H2O, también tiene NA moléculas, al igual que un mol de cualquier otra sustancia. Si N fuera la cantidad de moléculas de agua en un recipiente, la cantidad de moles, representada por la letra n, sería de n = N/NA. Entonces, la capacidad térmica molar, denotada por c*, es:
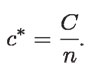
La respuesta térmica molar comparativa de una sustancia se refiere al cambio de temperatura cuando se energiza, por una cantidad fija de calor, una misma cantidad de átomos o moléculas. La respuesta térmica dependerá, entonces, de la forma de cómo esos NA elementos estén estructurados microscópicamente en 1 mol.
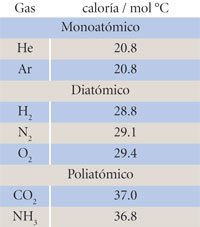
En la tabla siguiente se muestra la capacidad térmica molar de algunos gases, agrupándolos en monoatómicos, diatómicos y poliatómicos. La respuesta térmica de 1 mol de cada tipo de gas es muy parecida cuantitativamente.
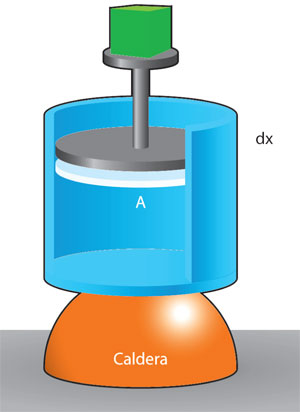
Al energizar una porción de sustancia por calor, generalmente aumenta su temperatura; un efecto adicional es que también puede aumentar su volumen. Si se vierte agua en un recipiente y se calienta, su volumen aumenta al recibir energía por calor de la flama; la expansión del agua se efectúa en contra del aire.
Supóngase que la superficie del agua se comporta como un pistón sin peso, de sección circular, que empuja el aire hacia arriba. El diagrama de la figura adjunta muestra que el agua vence en su dilatación la fuerza externa del aire. La fuerza total que el agua ejerce contra el aire es el producto de su presión p, por el área A de la superficie de contacto con el pistón:
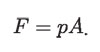
Si el pistón se mueve hacia arriba una distancia Δh = hf – hi, siendo hi la altura inicial y hf la altura final de la superficie del pistón imaginario, el agua habrá realizado un trabajo, W, contra la atmósfera dado por:
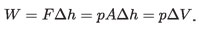
El producto AΔh no es más que el volumen de dilatación del agua, ΔV.