El consumo de gas en un hogar común urbano es de aproximadamente 20% para la cocción de alimentos y 80% para el calentamiento de agua. Pero, para calcular con exactitud la proporción del gasto de gas destinado a la cocción de alimentos se deben considerar varios factores: la dieta, la cantidad de habitantes en el hogar, los hábitos alimenticios, el tipo de estufa, etc. Los cálculos del ahorro se basarán, por lo tanto, en consideraciones generales.
Aunque los alimentos se pueden cocinar de diferentes formas —friéndolos en una sartén con aceite, poniéndolos en una olla con agua a hervir, entre otras—, aquí se considerará solamente el segundo caso, por ser el de mayor gasto de gas.
Cocer un alimento significa elevar su temperatura desde la del ambiente hasta la del punto de ebullición del agua (la que, como vimos, es de 100 °C a la altura del nivel del mar, pero disminuye con la altura del lugar). En este proceso se tienen las siguientes transferencias de energía: por un lado, la flama del gas transfiere energía por calor al recipiente de cocción, el agua recibe esa energía y empieza a hervir. Cuando hierve, el agua ya no aumenta su temperatura ya que comienza a evaporarse, pero al mismo tiempo continúa pasando energía por calor al alimento crudo, hasta que lo cuece.
Si una cantidad de agua, de masa m, estaba al inicio del calentamiento a la temperatura t0 y ésta se eleva a t, tenemos un incremento, denotado por Δt, de modo que,
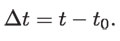
Este incremento de temperatura es ocasionado por un aumento ΔU en la energía interna del agua, dado por:
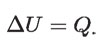
En esta ecuación, Q es la energía que por calor (quemando gas) pasa de la flama a la masa m de agua, hasta que su temperatura se eleva al valor t; es decir, es la energía transferida debido a la diferencia de temperatura entre la alta temperatura de la flama y la menor temperatura del agua. Esta ecuación se basa en el principio de conservación de la energía, que establece que la energía que recibe la masa m de agua por calor de la flama se invierte en aumentar su energía interna. La energía pasa de la flama al agua, de modo que se conserva. La cantidad de calor Q puede medirse por el efecto que produce en el agua, al elevar su temperatura en:
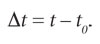
Si para una masa m fija de agua, la cantidad de calor Q se duplica, entonces el incremento de energía interna también se duplica, ocurriendo lo mismo con el cambio de temperatura de la sustancia que se está considerando. Es decir, Q y Δt son directamente proporcionales:
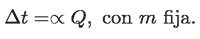
Pero ahora hay algo interesante: si la misma cantidad de calor Q hubiese aumentado la energía interna de una mayor cantidad de agua, el aumento de temperatura provocado hubiese sido menor. Esto se puede comprobar experimentalmente calentando en la flama medio litro de agua durante tres minutos y enseguida un litro de agua durante el mismo tiempo.
Es decir, para una sustancia determinada el cambio de temperatura, ante un incremento en su energía interna por calor, es inversamente proporcional a la cantidad de sustancia. Si la cantidad de sustancia aumenta en cierta proporción, el aumento de temperatura es inversamente proporcional.