¿Cómo varía el volumen con la temperatura, si ahora se deja fija la presión? El conocimiento de esta relación tiene gran importancia práctica, por ejemplo en el diseño de sistemas de ventilación, en que la dilatación de los gases por el incremento de la temperatura provoca corrientes de aire.
Por otra parte, el conocimiento del cambio de volumen con la temperatura a presión constante es relevante en materiales sólidos, como el hierro con el que se construyen las vías de ferrocarril.
En las vías se deja un espacio libre entre los rieles, para que al aumentar la temperatura tengan espacio para dilatarse; de lo contrario, la vía se levanta y se tuerce en los puntos de contacto, como se aprecia en la figura 8 (p. 420).
Al inicio se mencionó que la necesidad de saber el comportamiento de los gases cuando cambian las tres propiedades —presión, volumen y temperatura— surgió del diseño de barómetros, útiles en la predicción del tiempo atmosférico, pero también del diseño de los motores térmicos.
El barómetro es un instrumento que mide la presión atmosférica y el más común consta, básicamente, de una columna de mercurio (figura 9).
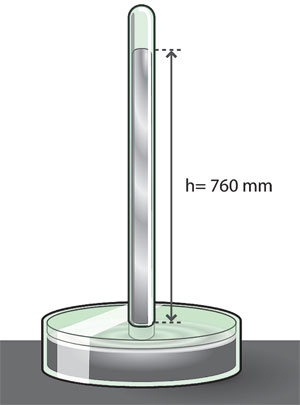
Se requiere conocer el cambio del volumen con la presión a temperatura constante, que es la ambiental. Una presión alta hace subir la columna de mercurio e indica "mal tiempo", y una presión baja, "buen tiempo".
En un motor térmico (véanse más adelante las figuras de los motores térmicos de Newcomen y Watt, pp. 443-444) el vapor de agua mezclado con el aire se dilata y contrae en el cilindro, haciendo que el pistón, junto con la acción del aire atmosférico, se mueva de arriba a abajo. En estos movimientos, la presión, temperatura y volumen de la mezcla dentro del cilindro cambian continuamente. Entender la relación entre estos cambios es básico para conseguir un motor eficiente, es decir, un motor que optimice el carbón que se quema en la caldera.
A la relación que hay entre las variables de un gas (volumen, presión y temperatura) se le conoce como ecuación de estado. A los físicos y químicos les tomó cientos de años descubrir la ecuación de estado de los gases. Por su simplicidad, la primera ecuación de estado que se obtuvo fue la de los gases poco densos o muy diluidos, también llamados gases perfectos o ideales.
La ley de Boyle-Mariotte especifica la relación entre el volumen y la presión de un gas, cuando la temperatura se mantiene constante. La ley se llama así porque fue obtenida demanera independiente por los científicos Robert Boyle (1627-1691), en 1660, en Inglaterra, y Edme Mariotte (1620-1684), en 1676, en Francia. La relación se puede determinar con una jeringa a la que se le quita la aguja y se sella el orificio. Ésta se mantiene en posición vertical, como se ilustra en la figura 10.
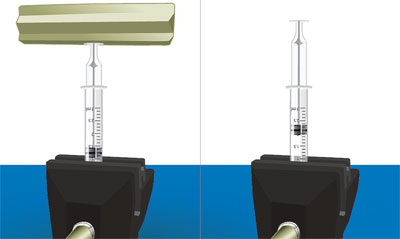
Después se agregan pesos variables sobre la base del émbolo de la jeringa y se analiza lo que pasa con el volumen del aire encerrado en su interior.
Las medidas se grafican en un plano cartesiano, donde el eje vertical corresponde al volumen y el eje horizontal a la presión, obtenida de dividir cada peso entre el área del émbolo. El experimento se realiza a temperatura constante, ya que el aire del interior de la jeringa está en contacto diatérmico con la atmósfera, de modo que:
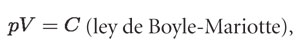
donde C es una constante relacionada con la temperatura del cuarto; se espera que cambie de valor al variar la temperatura a la que se realiza el experimento.
Si a temperatura constante se introduce más gas a la jeringa, el volumen tendrá que aumentar proporcionalmente, de modo que C no sólo depende de la temperatura, sino que también varía proporcionalmente con la cantidad de gas en el interior. Es decir:
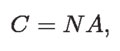
donde ahora A es el único factor que depende de la temperatura, y N es la cantidad de moléculas contenidas en el gas atrapado en la jeringa.
Siendo A proporcional a la temperatura (lo que ha sido determinado experimentalmente), se puede llamar k a la constante de proporcionalidad, de manera que:
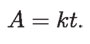
Sustituyendo A en la ecuación para C, queda:
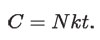
Reemplazando este valor de C en la ley de Boyle-Mariotte, nos da que:
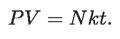
Es claro que t, en esta ecuación, no puede estar expresada en ninguna de las escalas de temperatura hasta ahora definidas.
Hay que tener en cuenta que en ambas escalas, Celsius y Fahrenheit, el origen de cada una se fija arbitrariamente, por lo que el cociente:
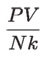
dependerá de dicho origen, mientras que p, V, N y k son cantidades que no son arbitrarias, sino que se determinan objetivamente.
Como en muchas otras cuestiones que demandan una respuesta apropiada, la indagación histórica proporciona el camino correcto: el científico francés Gay-Lussac (1778– 1850) encontró que, a presión constante, el volumen V variaba linealmente con la temperatura en la escala Celsius.
Además, Gay-Lussac y otros científicos hallaron que el cambio relativo de volumen, con la temperatura Δt = t – t0,
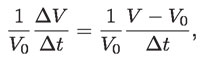
tiene el mismo valor para todos los gases, cuando su densidad es muy baja, es decir, cuando están muy diluidos o se comportan "idealmente"; es decir:
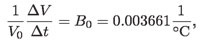
donde B0 es el llamado coeficiente de dilatación volumétrico a presión constante.
En la ecuación anterior, V0 es el valor del volumen a la temperatura inicial t0 = 0° C.
De la última ecuación, despejando ΔV se obtiene:
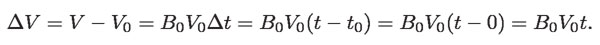
De aquí:
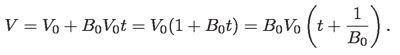
Ésta es la ley de Gay-Lussac, igualmente llamada de Charles (1746-1823), por haber sido descubierta también por este físico francés, de manera independiente.
Hay que recordar que en esta última ecuación, t es la temperatura en la escala Celsius y que, por eso, se trata de una temperatura que no es objetiva debido a que su origen ha sido fijado arbitrariamente, al asignar el valor 0 °C al punto de congelamiento del agua. Sin embargo, dado que el volumen tiene que ser mayor o igual a 0 m3, debe cumplirse que:
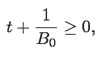
es decir,
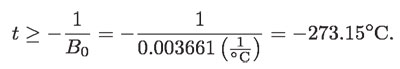
En otras palabras, t tiene que ser mayor o igual que –273.15 °C; de lo contrario, para temperaturas menores, el volumen de los gases sería negativo. El valor mínimo que se puede alcanzar en la escala Celsius es, por lo tanto, de –273.15 °C; es decir, el valor mínimo es un valor no arbitrario, que bien puede ser el origen objetivo de otra escala de temperatura también objetiva. Esta temperatura se define por:
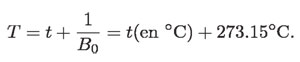
T es la escala llamada de Kelvin, en honor de William Thomson (1824-1907), quien más tarde sería Lord Kelvin. También es llamada escala de temperatura objetiva o absoluta. En esta escala se define el tamaño del grado Kelvin igual al tamaño del grado Celsius. En términos de ella, la ley de Gay Lussac-Charles queda como:
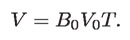
Obviamente V > 0 si T > 0. Pero siempre se tendrá que T > 0, porque t > –273.15 °C. El valor T = 0 K no se puede alcanzar, pues en tal punto el volumen de cualquier gas sería 0, lo que físicamente no tiene sentido.
En conclusión, la temperatura T que aparece en la ecuación debe ser la temperatura Kelvin. Con esto se tiene que los gases ideales cumplen con la siguiente relación entre sus variables p, V, T y N:
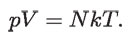
De modo que, tanto del lado izquierdo como del lado derecho de la ecuación se tienen cantidades objetivas. N es un número extraordinariamente grande, pues se trata de la cantidad de átomos o moléculas que hay en el volumen V, por ejemplo, un litro.
Conviene recordar ahora que la materia está formada de átomos; pero si los átomos se agregan en unidades mayores, entonces forman moléculas.
El agua, por ejemplo, está constituida de moléculas, formada cada una de ellas por dos átomos de hidrógeno y un átomo de oxígeno, por lo que su fórmula constitutiva se escribe como H2O.
El agua puede estar en estado de vapor, en estado líquido o en estado sólido, dependiendo de la distancia relativa entre las moléculas. En el estado gaseoso las moléculas estarán más alejadas unas de otras que en los estados líquido o sólido. La cantidad de sustancia es la cantidad de átomos o moléculas que una cierta porción de aquélla contiene. La unidad de cantidad de sustancia es el mol, que es el número de átomos que hay en 12 gramos del isótopo 12 de carbono.
En un mol de átomos de carbono 12 hay 6.02 × 1023 de estos átomos. Asimismo, la cantidad de moléculas H2O que hay en un mol de moléculas de agua es también 6.02 × 1023. De hecho, por definición, todos los mol de cualquier sustancia contienen la misma cantidad de átomos o moléculas: 6.02 × 1023. Y el número de Avogadro es la cantidad de elementos estructurales (átomos o moléculas) que hay en un mol. Ese número es 6.02 × 1023 y se le representa por NA:
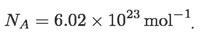
Después del número 6.02 × 1023 aparece la unidad
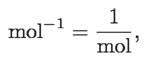
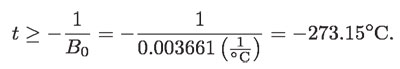
porque es el número de elementos estructurales por cada mol. Así, ¿cuántos elementos estructurales habrá en 2 mol de moléculas de agua? Pues:
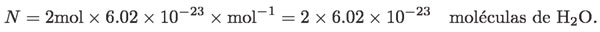
Si en una sustancia hay N elementos estructurales, podemos expresar tal número en mol, dividiendo entre Na. A la cantidad de moles la representaremos por la letra n. Por ejemplo, en el caso anterior:
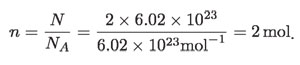
Siguiendo el razonamiento, se puede concluir que en 2 mol de moléculas de agua hay 4 mol de átomos de hidrógeno, 2 mol de átomos de oxígeno, 20 mol de protones, 20 mol de electrones y 16 mol de neutrones.
La cantidad de mol de electrones se obtiene así: en una molécula de agua H2O hay 10 electrones y, como se tienen 2 mol de moléculas de agua, habrá 20 mol de electrones.
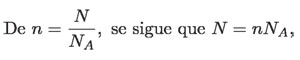
por lo que la ecuación de estado de los gases perfectos o ideales queda como:
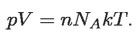
Pero el producto NAk no es más que la llamada constante de los gases, que se representa por R, que tiene un valor de 8.315 J/mol K. Y, con esto, finalmente obtenemos la ecuación de estado de los gases ideales:
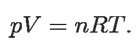
El aire, por ejemplo, se comporta siguiendo aproximadamente la ley de los gases ideales. Esto quiere decir que, para valores de p, T y n como los del ambiente, el valor calculado de V no difiere en más de 5% del valor correcto, experimentalmente medido.
Volvemos a la cuestión de la protección contra las altas temperaturas. Para combatir el calor veraniego habrá que tomar acciones tanto en lo personal como en las viviendas. En lo personal, podemos modificar la vestimenta en grosor y color, o emplear algún dispositivo sencillo como un abanico o un sombrero. En cuanto a la vivienda, se podrá utilizar algún dispositivo técnico, funcionando con electricidad o con algún combustible fósil, capaz de bajar la temperatura de las habitaciones, o bien construyendo las casas y edificios de modo que los vientos y el bloqueo de la iluminación solar permitan bajar la temperatura.
Es notoria la reducción en temperatura que en un día soleado producen las nubes al interponerse entre el Sol y el suelo. Siguiendo esta idea, es posible reducir apreciablemente la temperatura dentro de los edificios si se orientan en direcciones apropiadas, o si entre ellos y el Sol se interponen árboles u otros objetos que proyecten sombra, es decir, que impidan que la radiación solar llegue a sus superficies. La radiación solar es energía luminosa que nos llega del Sol; se trata de radiación electromagnética que transporta energía.
Algunos pueblos, sometidos a regímenes de radiación solar elevados, emplean ropas de color blanco. La razón se puede encontrar realizando un experimento casero con tres latas de refresco vacías. Una se pinta de negro, otra de blanco y la tercera se deja con su color original. Se llenan las tres latas con agua y se exponen al Sol en un día despejado. Se podrá apreciar que, al cabo de unos minutos, el agua de mayor temperatura está en la lata negra, seguida de la que no se pintó, siendo el agua de menor temperatura la de la lata blanca.
Ocurre que los cuerpos negros absorben mejor la radiación solar que los pintados de un solo color, y aun mejor que los de color blanco. Pero los cuerpos negros no pueden absorber toda la radiación, pues si así sucediera, su energía interna y su temperatura aumentarían tanto que llegarían a fundirse; en lugar de esto, los cuerpos negros emiten la radiación con la misma facilidad con que la absorben.
Los cuerpos blancos, por el contrario, son pésimos absorbedores de la radiación solar, la cual reflejan en gran proporción. Y de aquí que las telas de color blanco sean usadas en los lugares de alta irradiación solar.
Debido a que los colores oscuros absorben casi toda la radiación que les llega, las superficies de los calentadores solares se pintan de negro. Si debajo de la capa de pintura se pone un material de alta conductividad térmica, por ejemplo, un tubo de cobre que contiene agua, la energía de la radiación pasará fácilmente del cobre hacia el agua, calentándola por conducción.
El uso de ventiladores manuales, como un abanico, logra bajar la "sensación de calor"; es decir, la sensación de una alta temperatura, al acelerar el proceso de evaporación de las gotas de sudor en la piel.