De los experimentos de Rutherford se concluyó también que el núcleo, a su vez, está compuesto de partículas llamadas protones y neutrones. El descubrimiento del protón se le acredita a Rutherford. En 1918, él encontró que cuando se disparan partículas α contra un gas de nitrógeno, en sus detectores se registraron trazas de núcleos de hidrógeno.
Rutherford determinó que el único sitio del cual podían provenir estos núcleos era del nitrógeno y que, por lo tanto, el nitrógeno debía estar formado por núcleos de hidrógeno. Por estas razones Rutherford sugirió que el núcleo de hidrógeno debía ser una partícula fundamental, ahora conocida como protón. Para tratar de explicar que los núcleos no se desintegrasen debido a la repulsión electromagnética de los protones, el mismo Rutherford propuso en 1920, por primera vez, la existencia del neutrón.
En 1930, en Alemania, Walther Bothe (1891-1957) y H. Becker descubrieron que cuando se hacían incidir partículas α sobre berilio, boro o litio, se producía una radiación particularmente penetrante. Se pensó que eran rayos γ (gama), aunque los recién encontrados eran más penetrantes que los rayos γ hasta entonces conocidos, así que los detalles de los resultados experimentales eran difíciles de interpretar.
Dos años después esta teoría se desechó cuando, en París, Irène Joliot-Curie (1897- 1956) y Frédéric Joliot-Curie (1900-1958) mostraron que esta radiación desconocida, al golpear parafina u otros compuestos que contenían hidrógeno, producía protones de alta energía. Eso era consistente con la suposición de que eran rayos γ.
Por último, a finales de 1932, el físico inglés James Chadwick (1891-1974), en Inglaterra, continuó con experimentos similares a los científicos anteriores de los que obtuvo resultados que no concordaban con los predichos por la teoría.
Para explicar tales resultados fue necesario suponer que la radiación estaba formada por corpúsculos, así que éstos quedaron explicados, aunque fue necesario aceptar que las partículas que formaban la radiación no tenían carga eléctrica. Tales partículas debían tener una masa muy semejante a la del protón, pero sin carga eléctrica. Así se identificó al neutrón como una nueva partícula.
La precaria identidad de los "átomos" de Dalton, que Dmitri Mendeléiev (1834-1907) ordenó en su célebre tabla periódica, empeoró con la aparición del protón y el neutrón. Los que convencionalmente conocemos como átomos, no son indivisibles, pero tampoco son los átomos de la definición de Demócrito ya que los podemos separar en electrones, protones y neutrones.
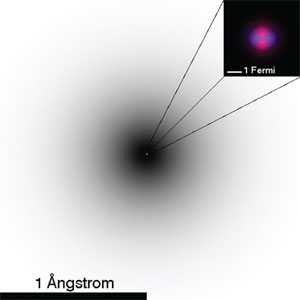
No obstante, con estas tres partículas podemos reproducir todos los elementos de la tabla periódica y, por lo tanto, todo lo que nos rodea. La historia no requería más. Por segunda vez, la búsqueda parecía haber concluido: estas tres partículas parecían ser los átomos de Demócrito (véase figura 12).
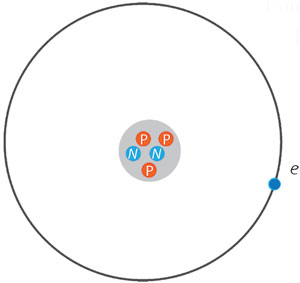
Por supuesto había preguntas importantes, todavía sin respuesta. Por ejemplo: si el núcleo de un átomo puede tener más de cien protones, todos cargados y positivos, y por lo tanto, todos repeliéndose, ¿por qué no estallan los núcleos atómicos? ¿Qué les da estabilidad? O al revés: ¿por qué no vemos que los electrones se agrupen? Pero esto no se consideró trascendente.