De acuerdo con Rutherford, el dispositivo experimental era un tubo de vidrio que encerraba a la fuente de partículas α, que incidirían sobre una delgada lámina de oro, y fueron sustituidas por pantallas detectoras cilíndricas para cubrir las posibles desviaciones de 45° o más (véase figura 10, p. 480).
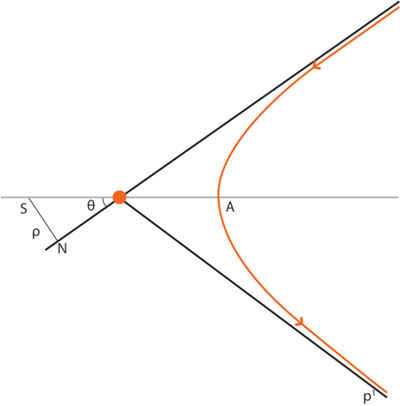
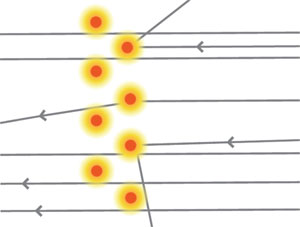
A principios de 1911 Rutherford buscó a Hans Geiger. En contra de todo lo esperado, se encontró que de los millares de partículas α disparadas a través de la lámina de oro, algunas, muy pocas, sufrieron una gran desviación. Una o dos se habían desviado más de 90º, saliendo del blanco por el mismo lado que entraron. Rutherford estaba convencido de que tales rebotes no podían deberse a una serie de colisiones de una partícula α con los electrones. Era como si un tráiler rebotara al colisionar con una bicicleta (véase figura 11).
El sencillo modelo atómico de Thomson no explicaba nada de esto. Al llegar a este punto podría haberse concluido que los resultados eran incorrectos. Sin embargo, Rutherford tomó los resultados como buenos: "Hay algo en el átomo que puede hacer rebotar a las veloces y pesadas partículas α."
El cálculo le indicó que debían de haber encontrado un campo eléctrico muy fuerte. Semejante intensidad podría ser producida por una carga eléctrica concentrada en un espacio muy pequeño. Estaba tomando forma una nueva hipótesis: "La electricidad positiva del átomo no es —como creía J. J. Thomson— un fluido distribuido uniformemente por el átomo, sino que está concentrada en el centro, en un volumen muy compacto."7
Basándose en esta idea, Rutherford se planteó un problema: dada una carga eléctrica y una cantidad conocida de partículas α dirigiéndose hacia ella con una velocidad conocida, ¿cuál sería la dispersión más probable? ¿Cuántas partículas se acercarían lo suficiente al centro cargado para dispersarse con ángulos de 20°, 45°, 60° y 90°?
Rutherford calculó la respuesta y la comparó con sus observaciones y con los resultados de otros experimentos de dispersión realizados con anterioridad. Las observaciones mostraban una gran compatibilidad con los cálculos que surgían de su hipótesis. Aquello lo entusiasmó y le dio seguridad, pero su modelo debía ser puesto a prueba con mayor detalle. Con Ernest Marsden (1889-1970) y Geiger ideó nuevos experimentos de dispersión. Antes de dar por concluido su trabajo, se contaba con más de un millón de destellos para analizar.
En mayo de 1911, Ernest Rutherford publicó su primer artículo acerca de lo que habían encontrado y anunció así el descubrimiento del núcleo, como llamó al centro de carga positiva del átomo. De sus experimentos, concluyó que el núcleo era 10 mil veces menor que el átomo; tan pequeño como una cabeza de alfiler en la sala vacía de una casa. No obstante, en el núcleo reside casi toda la masa del átomo. Fuera de este punto diminuto y pesado, en el centro del átomo, habría espacio vacío. Ahí están los electrones en número suficiente para compensar la carga positiva del núcleo.
Puede que no carezca de interés el tratar de imaginarnos el concepto que hasta ahora nos hemos formado del átomo. Para ello elegiremos como ejemplo el átomo más pesado de todos, el de uranio. En el centro del átomo hay un núcleo diminuto, en torno del cual se arremolina un conjunto de 92 electrones, los cuales se mueven recorriendo órbitas determinadas y ocupando, aunque de ninguna manera llenando, un volumen muy grande en comparación con el núcleo.
Algunos electrones recorren órbitas casi circulares alrededor del núcleo; otros, órbitas de forma elíptica, con ejes que giran con rapidez alrededor del núcleo.8