En 1909, el electrón era la única partícula atómica que se conocía. Para explicar la neutralidad del átomo, Thomson sugirió que los electrones estaban embebidos en una nube con carga positiva distribuida homogéneamente en el átomo. Este modelo parecía razonable, pero había que probar la consistencia de las suposiciones que lo sustentaban. Había mucho por averiguar.
Ernest Rutherford (1871-1937) llevaba diez años estudiando las partículas emitidas por ciertos materiales radiactivos, a las que llamaba α (alfa), y se disponía a probar el modelo propuesto por Thomson. Demostró que las partículas alfa tienen carga positiva, son más pequeñas que los átomos, son pesadas (tienen masa) y las emiten las sustancias radiactivas con una gran velocidad. Siendo así, estas partículas podían emplearse como proyectiles de alta energía para estudiar a los átomos.
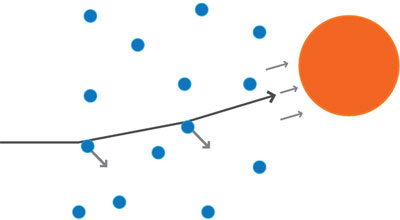
Con su colaborador Hans Geiger (1882-1945), Rutherford enviaba haces de partículas α a través de diversos materiales y, mediante pantallas fluorescentes, similares a la de un televisor, detectaba el lugar de salida. Así, podían observar si se desviaban a causa de las posibles interacciones en su viaje al interior de átomo. Por aquellos días, ellos habían disparado miles de proyectiles contra sus delgados objetivos y ninguno se había desviado más allá de unos pocos grados (figura 7).
Estas leves desviaciones parecían deberse a la influencia que ejercía la carga negativa de los electrones existentes en el átomo sobre la carga positiva de la partícula disparada (figura 8).
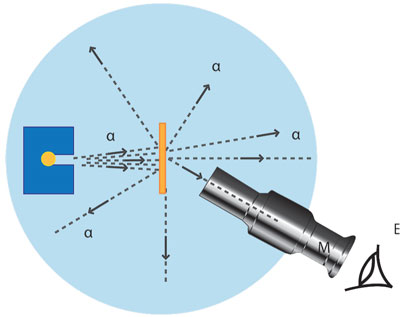

De acuerdo con cálculos probabilísticos, existía la posibilidad de que, al pasar a través de las muestras, la partícula se encontrara con un electrón, luego con otro y otro. El efecto de aquellos encuentros sucesivos podría dar, teóricamente, una desviación hasta de 45°, pero la probabilidad era pequeñísima. Sobraban razones para esperar que, más allá de los 45°, no se detectara nada. Sin embargo, había que probarlo experimentalmente (figura 9).