Cuando en 1895 se concluyó que los rayos catódicos se comportaban como la corriente eléctrica, cobró fuerza la idea de que debían ser partículas, como lo enunció Benjamin Franklin, siglo y medio atrás. Se asumía, igualmente, que mostrar la existencia de una unidad fundamental en carga y masa sería definitivo para comprobar la idea de que se trataban de partículas, por lo que los físicos de la época se dieron a esa tarea.
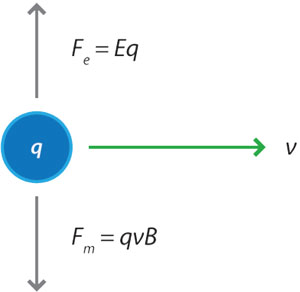
En 1897, Joseph John Thomson (1856-1940) diseñó un tubo de rayos catódicos en el cual, después de colimar (afinar) el haz, lo hacía pasar entre dos placas de carga controlada, cuyo campo eléctrico atraía al haz en una dirección, mientras un campo magnético lo atraía en la dirección contraria. Por último, chocaba con una pantalla fluorescente al final del tubo (figura 5).
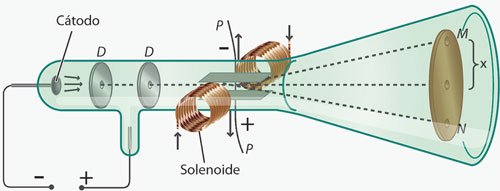
Al aplicar simultáneamente los campos eléctrico E y magnético B, graduándolos de tal modo que la desviación debida a un campo se anulaba por el otro, Thomson podía asumir que las fuerzas eléctrica y magnética eran de igual magnitud pero de sentido contrario y, como consecuencia, pudo calcular la velocidad de los rayos catódicos.
La fuerza eléctrica está dada por:
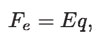
y la magnética por:
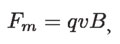
donde E es la magnitud del campo eléctrico; q la carga de la partícula constituyente de los rayos catódicos y v su velocidad. Dado que estas fuerzas deben ser iguales:
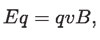
de donde:
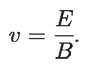
Cuando Thomson sustituyó los valores respectivos de los campos que estaba usando, vio que esta velocidad era de varios miles de kilómetros por segundo, aproximadamente un quinto de la velocidad de la luz, y que dependía del campo eléctrico entre ánodo y cátodo, como se desprende de la ecuación.
En otro experimento, el cual consistía en aplicar un campo magnético uniforme, observó que el haz se cerraba sobre sí mismo formando un círculo. Esto le permitió asumir que la fuerza generada por el campo magnético actuaba siempre perpendicular al haz y al campo magnético, lo cual obligaba a tener una trayectoria circular, con la fuerza magnética apuntando hacia el centro. Es decir:
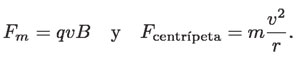
Así, igualando estas ecuaciones:
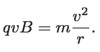
Sustituyendo la velocidad medida anteriormente, la magnitud del campo magnético utilizado B y el radio r de la trayectoria observada, concluyó que:
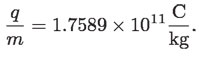
Bastaría conocer la carga para poder calcular la masa de la partícula de los rayos catódicos, ya que Thomson desconocía la carga y la masa del corpúsculo, pero conocía su cociente.5 Robert A. Millikan, en 1909, diseñó un aparato que le permitía "balancear" en el aire una pequeña gota de aceite ionizada por un haz de rayos x, que caía a través de un campo eléctrico.
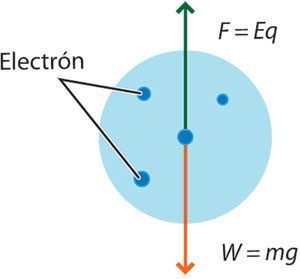
Ajustaba el campo E hasta que la fuerza eléctrica y el peso eran iguales en magnitud pero de sentido contrario, anulándose la fuerza total sobre la gota que caía con velocidad constante. Esto le permitió calcular la carga de cada gota.
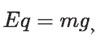
en donde la masa se determinaba multiplicando el volumen de la gota (considerándola esférica) cuando caía, por la densidad del aceite (véase figura 6, p. 478). Usando las cargas medidas para diferentes gotas y suponiendo que eran múltiplos enteros de una carga fundamental e, Millikan fue capaz de determinar que:
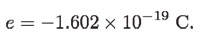
Una vez establecida por Millikan la carga fundamental, que sería entonces la del electrón, fue posible determinar su masa usando la relación de Thomson antes mencionada,
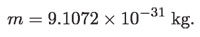
Más adelante, Thomson escribiría en sus Recuerdos y reflexiones, publicados en 1936:6
Tras largas meditaciones acerca de los experimentos, me pareció que eran ineludibles las siguientes conclusiones:
Los átomos no son indivisibles; de ellos pueden arrancarse partículas cargadas de electricidad negativa, mediante la acción de fuerzas eléctricas, el choque de átomos que se mueven con rapidez, la luz ultravioleta o el calor.
Todas esas partículas son idénticas en cuanto a la masa y llevan idéntica carga eléctrica negativa, sea cual fuere la especie de átomos de que salgan, y son elementos constitutivos de todo átomo.
La masa de dichas partículas es menos de un millonésimo de la masa del átomo de hidrógeno.
Al principio di a esas partículas el nombre de "corpúsculos", pero ahora se designan con el más apropiado de "electrones".
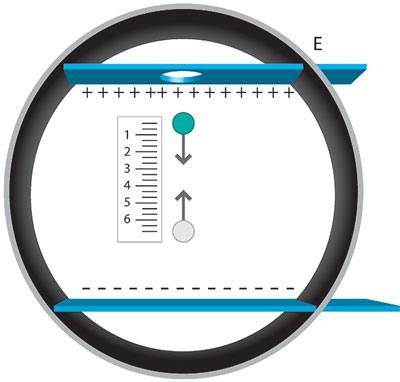
Figura 6. Esquema del experimento de Millikan.
Con esta conclusión, la idea de átomo de John Dalton fue severamente golpeada, ya que no podía considerarse más una partícula indivisible, pues se había encontrado ahora un corpúsculo mucho más pequeño en su interior: el electrón.