En esta sección se describe la organización de la célula, es decir, de sus diferentes partes. Abarca la explicación de elementos celulares comunes a procariontes y eucariontes, como la membrana biológica y los ribosomas. Sin embargo, varios de los componentes que se explican corresponden a la célula eucarionte, que contiene mayor número de estructuras.
La célula es un espacio rodeado por una membrana semipermeable que separa dos ambientes acuosos en los cuales se encuentran disueltas una variedad de sustancias. Las sustancias disueltas en el citosol son pequeñas moléculas, como azucares, aminoácidos, nucleótidos y vitaminas, además de iones inorgánicos, como sodio, cloro y calcio. Algunas de estas pequeñas moléculas (monómeros) se unen para formar moléculas de tamaño variable denominadas polisacáridos, proteínas y ácidos nucléicos.
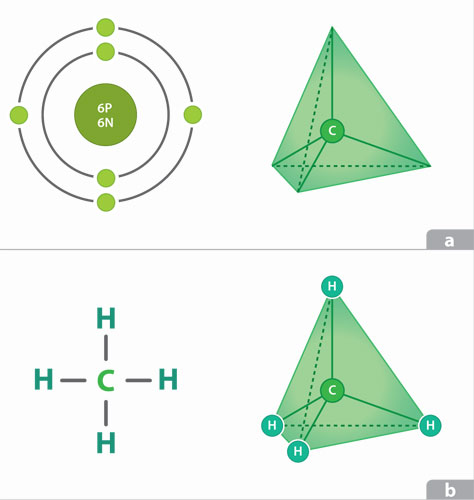
Los compuestos orgánicos característicos de la química celular se basan en el carbono con cualidades únicas que lo han hecho insustituible para el desarrollo de la vida. Debido a que el carbono necesita cuatro electrones para llenar su orbital externo, puede compartir electrones con otro carbono o con otros elementos para formar compuestos estables y extremadamente variables como el metano.
La mayoría de los compuestos orgánicos tienen, además de carbono, hidrogeno, oxigeno y a menudo nitrógeno, azufre y fosforo. Estos elementos se agrupan generalmente en los llamados grupos funcionales, que tienen propiedades importantes como su solubilidad en el agua y la posibilidad de reaccionar entre sí. Los compuestos de carbono más importantes para la vida son los carbohidratos, los lípidos, las proteínas y los ácidos nucléicos.
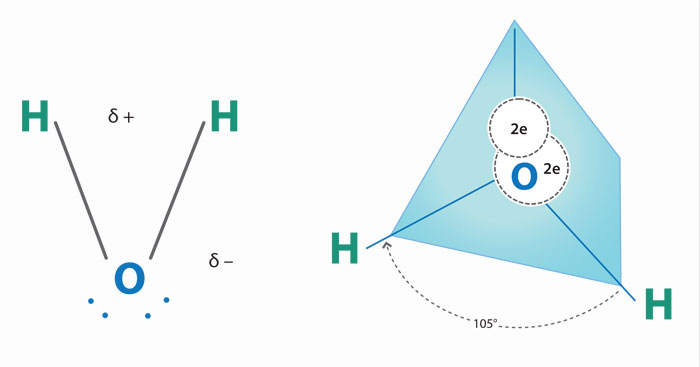
El agua, componente mayor e imprescindible para la vida, disolvente por excelencia, interacciona con iones y diversas moléculas de la célula, gracias a su polaridad. El oxigeno del agua comparte electrones con dos átomos de hidrogeno pero, debido a la electronegatividad del oxigeno, los electrones no se comparten de igual manera; el oxigeno atrae al electrón del hidrogeno, el cual adquiere una carga parcial positiva, mientras el oxigeno queda con una carga parcial negativa.
Las consecuencias de lo anterior son enormes. Las moléculas de agua se mantienen unidas entre si, gracias al enlace de hidrogeno que se forma entre el hidrogeno de una molécula de agua y el oxigeno de otra, aunque también el hidrogeno del agua atrae a los átomos electronegativos de otras moléculas como aminoácidos y nucleótidos. La polaridad del agua permite también la interacción entre ella y las cargas positivas o negativas de los iones.
Por lo tanto, en la célula existen moléculas hidrofílicas, es decir, solubles en agua, mientras otras, como los lípidos, son hidrofóbicas, es decir, incapaces de interactuar parcial o completamente con el agua. La existencia de ambos tipos de sustancias favoreció el desarrollo de estructuras celulares, como las membranas, y propicio el desarrollo del metabolismo, en el cual tienen también un importante papel los protones altamente reactivos, producto de la ionización de algunas moléculas de agua.
Además de los puentes de hidrogeno existen otros enlaces débiles, es decir, no covalentes; por ejemplo, los enlaces iónicos, que resultan de la atracción entre la carga positiva de un catión y la carga negativa de un ion negativo o anión. En solución acuosa, los iones de interés biológico como Na+, K+, Mg2+ o Cl- se encuentran rodeados por una capa de agua que se coloca de acuerdo con la carga del ion: los iones negativos establecen relación con el hidrogeno, mientras los positivos atraen al oxigeno. Sin embargo, cuando los iones van a atravesar un canal iónico, deben deshacerse de su capa acuosa para que los iones puedan interaccionar con las proteínas de membrana que forman el canal.
Los pequeños compuestos de carbono, azucares, aminoácidos y nucleótidos, denominados genéricamente monómeros, pueden unirse entre si, mediante eliminación de agua, para formar polímeros, es decir, polisacáridos, proteínas y ácidos nucléicos. Los polisacáridos, por estar constituidos en su gran mayoría por monómeros idénticos, proporcionan poca información a la célula, a diferencia de las proteínas y los ácidos nucléicos, que presentan gran complejidad en el arreglo de sus monómeros, por lo tanto poseen la propiedad de portar gran cantidad de información indispensable para la realización de la mayoría de las actividades celulares.
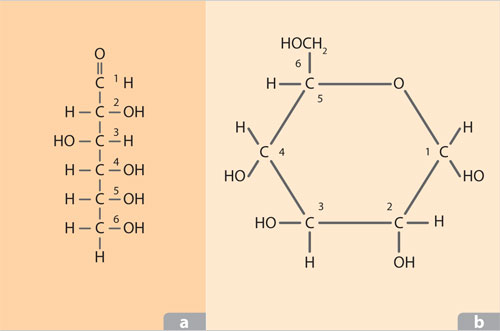
Este grupo de compuestos incluye monosacáridos, oligosacáridos y polisacáridos. Los primeros están formados por 3, 4, 5, 6, 7 y 8 átomos de carbono. De estos, el más importante es la glucosa, por ser la molécula mas usada como fuente de energía y por formar parte importante de diversas vías metabólicas.
Los azucares se presentan en dos configuraciones: lineal y cíclica, esta ultima presente en azucares de cinco o más carbonos. La estructura lineal, además de tener los hidroxilos característicos del grupo, incluye un grupo aldehído o un grupo cetona, de ahí los nombres que detentan: aldosas o cetosas. La presencia de estos dos grupos funcionales es importante porque intervienen en la formación de la estructura cíclica, imprescindible para que los azucares puedan unirse mediante los enlaces glicosídicos.
La clasificación de los azucares depende del número de subunidades integradas mediante el enlace glicosídico: disacáridos, como la sacarosa o azúcar de mesa que está formada por glucosa y fructosa; oligosacáridos constituí dos por escasas subunidades de azúcar (muchos de ellos presentes solamente en este tipo de carbohidratos), de gran importancia en el reconocimiento celular y que pueden funcionar como antígenos, como en el caso de los oligosacáridos responsables de los grupos sanguíneos A, B y O; y polisacáridos, que pueden estar formados por miles de subunidades, como la celulosa y la quitina. Si presentan una subunidad son monosacáridos.
La presencia de grupos hidroxilos en su molécula propicia la formación de enlaces glicosídicos muy variados, que dan lugar a moléculas con características fisicoquímicas diferentes. Además, por esta razón, su estructura puede ser lineal o ramificada y, por lo tanto, sus posibilidades de interacción con otras moléculas son muy grandes. Esto es evidente, sobre todo en los oligosacáridos que se encuentran unidos a lípidos y proteínas de la membrana celular y en los polisacáridos que forman la matriz extracelular, los cuales son fundamentales para el reconocimiento celular, por ejemplo, en los procesos de fecundación y en la formación de tejidos y órganos. La gran variedad de conformaciones que muestran estas moléculas es una prueba de que transmiten información relevante para el funcionamiento adecuado de los organismos.
Se trata de un grupo muy heterogéneo que tiene en común el ser parcial o totalmente insoluble en agua. Pueden servir como reservas de energía, como aislantes térmicos y como hormonas. Otros se modifican para formar vitaminas; los carotenoides, por ejemplo, ayudan en la captura de la luz. Su papel más importante es el de formar membranas celulares.
Los ácidos grasos son las formas más simples de lípidos; se caracterizan por poseer una cadena hidrocarbonada hidrofóbica o no polar, con un grupo carboxilo hidrofílico situado en uno de los extremos. El tamaño de las cadenas de carbonos es variable, aunque en las células son comunes los de 16 y 18 carbonos. Estas moléculas son saturadas si los átomos de carbono contienen el máximo de hidrógenos que pueden tener o bien insaturados si poseen una o varias dobles ligaduras. Estas causan una torcedura en la cadena que impide a las moléculas acomodarse apretadamente; esto marca la diferencia entre los llamados aceites o margarinas y las grasas, y explica la fluidez de las membranas celulares, que poseen ácidos grasos saturados y no saturados.
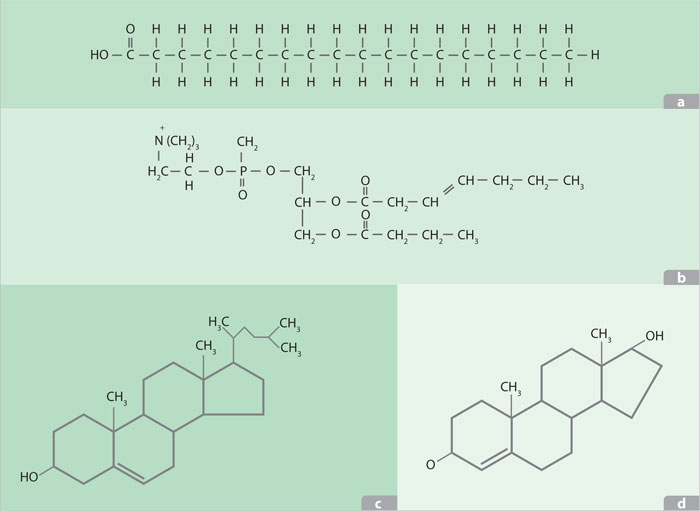
Los ácidos grasos normalmente se encuentran formando parte de los triacilglicéridos o grasas, constituidos por una molécula de glicerol y tres ácidos grasos unidos mediante un enlace ester. Los triacilglicéridos son insolubles en agua y, por lo tanto, resultan sustancias muy apropiadas para actuar como reserva de energía, pues ocupan menos espacio que los carbohidratos. Cuando se necesita energía, los ácidos grasos se separan del glicerol y entran en un proceso de formación de una sustancia de dos carbonos (acetilo), que es la misma que se forma cuando la glucosa ingresa en la vía para la liberación de energía.
La mayoría de los fosfolípidos que forman parte importante de las membranas celulares son parecidos a los triacilglicéridos. El fosfolípido más sencillo presenta un fosfato en el carbono 3 del glicerol, mientras otros fosfolípidos unen una pequeña molécula polar al fosfato: colina, etanolamina, inositol o serina. La esfingomielina es otro tipo de fosfolípido que tiene el alcohol aminado esfingosina, en lugar del glicerol.
Los fosfolípidos son sustancias antipáticas, esto es, poseen una "cabeza polar" hidrofílica, mientras los ácidos grasos constituyen las "colas" hidrofóbicas que se unen entre sí al ser desplazadas por el agua. Esta característica de los fosfolípidos es la base para la formación de bicapas que son propias de las membranas celulares.
Además de los fosfolípidos, en las membranas encontramos glicolípidos y colesterol, este ultimo presente en las células animales. Los primeros constituyen los llamados gangliosidos y cerebrosidos abundantes en el tejido nervioso y cuyo metabolismo, alterado por una mutación, está asociado a graves enfermedades hereditarias como las de Tay-Sachs y de Gaucher.
El colesterol es una molécula formada por cuatro anillos y una cadena lineal hidrocarbonada. La molécula es muy hidrofóbica, con excepción del grupo hidroxilo que se encuentra en uno de los anillos. En las membranas, el hidroxilo se encuentra entre las cabezas polares de los demás lípidos, mientras el resto de la molécula se encuentra en contacto con las colas hidrofóbicas.
El colesterol es también la molécula base para la síntesis de las hormonas esteroides, como el estrógeno y la testosterona, que son moléculas señal que llevan mensajes de una célula a otra, para regular el desarrollo sexual de los vertebrados.
Los ácidos desoxirribonucleico (ADN) y ribonucleico (ARN) son los principales portadores de la información celular. Se cree que en el principio de la vida en nuestro planeta, el ARN pudo haber sido el depositario de la información genética; sin embargo, con el paso del tiempo, el ADN fue favorecido por la selección natural en virtud de su estabilidad química.

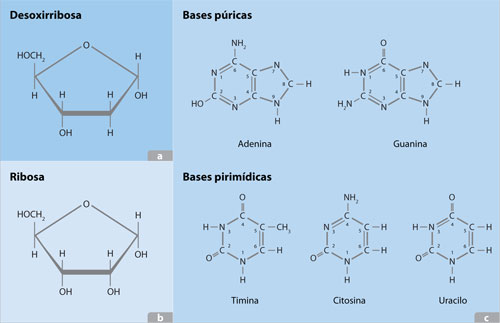
Los nucleótidos que constituyen las subunidades de los ácidos nucléicos están formados de uno o varios fosfatos, un azúcar (desoxirribosa y ribosa) y una base nitrogenada. Las bases nitrogenadas son las purinas: adenina y guanina y las pirimidinas: citosina, timina y uracilo. El ADN está formado por adenina, timina, guanina y citosina. El ARN está formado por adenina; uracilo, en lugar de timina; guanina y citosina. Las bases nitrogenadas toman su nombre de la capacidad que tiene el nitrógeno para captar un protón, lo cual provoca un aumento de iones OH– del agua.

Los nucleótidos son moléculas muy versátiles, pues además de formar parte de los ácidos nucléicos son capaces de transferir energía, como es el caso del adenosín trifosfato (ATP) y el guanosín trifosfato (GTP); o bien, pueden ser coenzimas de deshidrogenasas como el NAD+, que tiene un papel importante en la transferencia de hidrógenos a la cadena respiratoria.
Los nucleótidos que constituyen el ADN y el ARN se unen para formar cadenas cuya polaridad se expresa a través de señalar si el carbono 5' o 3' del azúcar se encuentran libres en el extremo de la cadena. Esto significa que en el hidroxilo del carbono 3' de la desoxirribosa o de la ribosa se une el grupo fosfato de un nucleótido, una y otra vez, dependiendo de las instrucciones que de la otra cadena de acido nucléico. Los enlaces así formados se denominan fosfodiéster y permiten que la molécula vaya creciendo en dirección 3'.
Los nucleótidos necesarios para producir ADN son trifosfatados, por ejemplo, dATP, dGTP, dCTP o dTTP. La letra d significa que el azúcar es la desoxirribosa y que, por lo tanto, este nucleótido formara parte del ADN. Al momento de unirse el nucleótido al carbono 3' de la desoxirribosa, dos de los fosfatos del nucleótido trifosfatado se desprenden (PPi), y la energía liberada permite la unión del fosfato restante con el hidroxilo de la pentosa. Es así como el nucleótido trifosfatado es, a la vez, fuente de energía y monómero para permitir el crecimiento de la hebra. El mismo proceso permite la síntesis de las moléculas de ARN, solo que para ello se requieren nucleótidos trifosfatados cuyo azúcar es la ribosa y contienen uracilo en lugar de timina.
El ADN es una molécula de doble cadena en forma de doble hélice. Las cadenas son antiparalelas, es decir, mientras una va en dirección 5' a 3', la otra se orienta en sentido contrario. El modelo más simple para describir al ADN es una escalera de caracol, cuyos peldaños están constituidos por los pares de bases A-T y C-G, unidos mediante enlaces de hidrogeno y cuyos pasamanos son los fosfatos y los azucares.
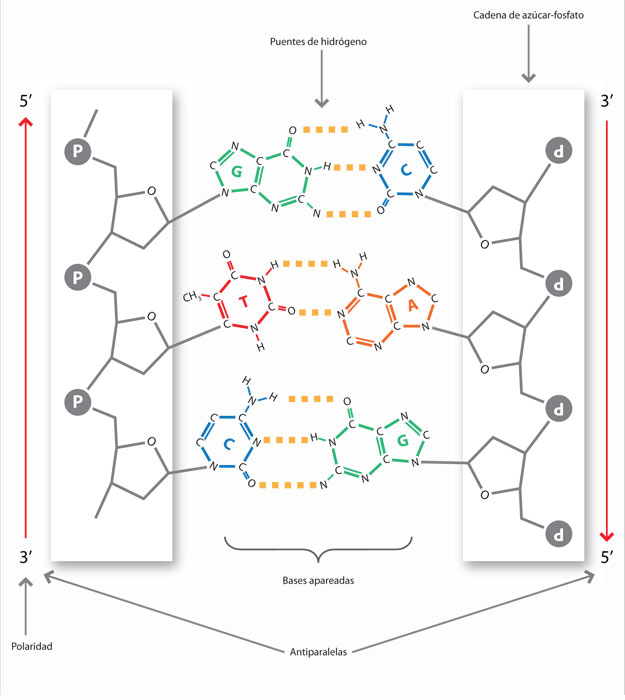
La unión de una cadena de polinucleotidos (5' a 3') se lleva a cabo por la unión de puentes de hidrogeno entre las bases nitrogenadas: A se une a T con dos puentes de hidrogeno y C se une a G a través de tres. Esa unión da estabilidad para formar la estructura en doble hélice.
Existen varios tipos de ARN: 1] el ARN mensajero, que contiene la información para la síntesis de la proteína; 2] el ARN ribosomal, que es parte del ribosoma y promueve la formación del enlace peptídico entre aminoácidos; 3] el ARN de transferencia, que porta los aminoácidos necesarios para la síntesis de proteínas, y 4] los ARN pequeños del núcleo ricos en uracilo (UsnARNs), que participan en la maduración de los ARN en los eucariontes. Los ARN son polinucleótidos de una sola cadena que puede formar enlaces de hidrogeno entre sus propias bases.
Los apareamientos específicos entre las bases nitrogenadas son la clave para entender las dos propiedades características de los ácidos nucléicos: la transcripción y la traducción de la información, así como su duplicación. Estos aspectos se tratan con amplitud en el capítulo de genética.
La información que codifica el ADN está destinada a la síntesis de moléculas de ARN, que a su vez son el molde para la producción de una proteína. Estas moléculas son polímeros formados por la combinación de 20 aminoácidos, cada uno de los cuales está formado por un grupo carboxilo, un grupo amino, una cadena lateral y un hidrogeno.
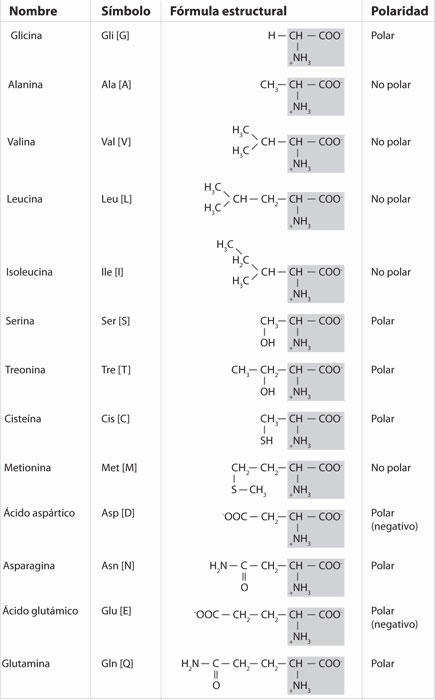
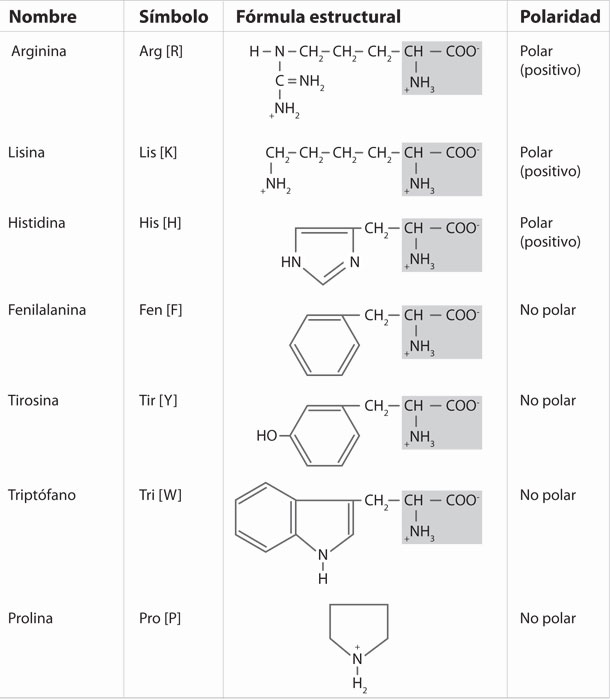
Las proteínas son las más diversas y abundantes de todas las biomoléculas. Esto se debe al número y a la combinación de aminoácidos que presenta cada proteína y a que cada aminoácido presenta características diferentes gracias a su cadena lateral, que tiene diferente tamaño, forma y capacidad de reacción. La naturaleza química de los grupos laterales de los aminoácidos permite agruparlos en cuatro grandes categorías: los que no interactúan con el agua y, por lo tanto, son no polares, y los que interactúan con el agua: polares electrónicamente negativos, polares electrónicamente positivos y polares sin carga eléctrica.
Los grupos laterales definen las características de las proteínas y, por consiguiente, la función celular que desempeñan. Por ejemplo, una proteína que se encuentra en un ambiente acuoso tiene sus aminoácidos polares hacia el exterior, mientras los aminoácidos hidrofóbicos se localizan en el interior de la molécula. Asimismo, las proteínas que se encuentran integradas a las membranas celulares presentan regiones de aminoácidos polares que miran hacia la región acuosa exterior e interior de la célula, mientras la región integrada a la membrana está formada por aminoácidos no polares que interactúan perfectamente con las colas hidrofóbicas de los lípidos.
Las funciones que desempeñan las proteínas son tan variadas como su estructura: actúan como transportadoras de sustancias (como las hemoglobinas); transmiten información y regulan funciones (como la insulina); son parte importante del sistema inmunológico (los anticuerpos); proveen el soporte, y por lo tanto la estructura de las células; permiten el movimiento y la contracción (miosina, actina y las proteínas del citoesqueleto) y, lo más importante, muchas proteínas actúan como catalizadores biológicos (las enzimas).
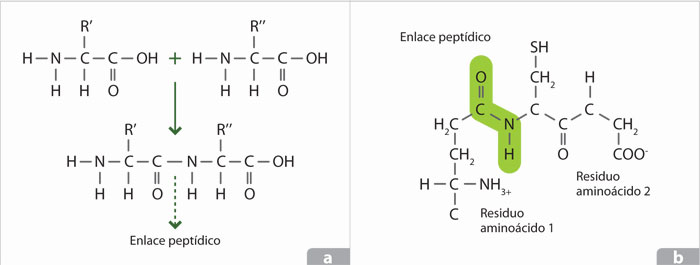
La unión de los aminoácidos se efectúa en los ribosomas, en el citosol de la célula, en una reacción que depende de la presencia del ARN ribosomal y que da lugar a la formación de los enlaces peptídicos, liberando agua; estos unen el grupo carboxilo terminal de un aminoácido con el grupo amino terminal del otro, de tal manera que el extremo inicial de la molécula (que se denomina genéricamente polipéptido) es un grupo amino, mientras el extremo terminal siempre es un carboxilo. El crecimiento de la cadena del péptido y los aminoácidos que deben colocarse están regulados por la información que lleva el ARN mensajero a los ribosomas.
La designación común de síntesis de proteínas para el proceso de agregación de aminoácidos no es del todo correcta, porque en realidad lo que se sintetiza es un polipéptido; el nombre de proteína se refiere al producto acabado que ha adquirido una estructura tridimensional con menor energía libre y, por lo tanto, es ya capaz de ejercer su función.
Las proteínas presentan varios grados de complejidad con menor energía libre, que se denominan estructuras: 1] la estructura primaria se refiere a la secuencia de aminoácidos, que está determinada por la información contenida en el ARN mensajero, de acuerdo con el código genético; 2] de la estructura secundaria son responsables los puentes de hidrogeno que se forman entre los grupos amino y carbonilo de aminoácidos de la misma cadena; 3] la estructura terciaria se refiere a interacciones complejas que resultan de la formación de enlaces débiles, interacciones hidrofóbicas y enlaces disulfuro, que se dan entre las cadenas laterales de los aminoácidos que se encuentran en tramos distantes de la molécula, y 4] la estructura cuaternaria corresponde a la interacción de dos o más cadenas de polipéptidos que se unen mediante enlaces débiles y enlaces disulfuro.
En 1953, Frederick Sanger determino por vez primera la estructura primaria de una proteína, la hormona insulina. Encontró que esta pequeña proteína estaba constituida por dos cadenas unidas por dos puentes disulfuro. Lo más importante del descubrimiento de Sanger fue el hallazgo de que cada proteína estaba formada por secuencias específicas de aminoácidos.
La secuencia de aminoácidos es la primera fase del reconocimiento de las cualidades de una proteína. Los siguientes niveles de organización proteica tienen que ver con la formación de estructuras tridimensionales que explican las funciones en las cuales están involucradas estas moléculas.
La estructura secundaria fue propuesta por los químicos Linus Pauling y Robert Corey, quienes encontraron que existían dos tipos que denominaron α hélice y plegamiento β. Ambos tenían en común la formación de puentes de hidrogeno entre los grupos CO y NH de aminoácidos vecinos. La α hélice se enrolla sobre sí misma, mientras el plegamiento β forma estructuras plegadas que unen dos polipéptidos adyacentes o varios tramos de un mismo polipéptido y que están orientados paralela o antiparalelamente. Las proteínas fibrosas como las queratinas del pelo y de la lana, la fibroína de la seda y la colágena de los huesos y de la piel, presentan estructura secundaria.
En la estructura terciaria, los enlaces débiles entre aminoácidos situados en diferentes regiones, pliegan la proteína de formas muy variadas y relacionadas con la función que le corresponde. Frecuentemente, en las proteínas llevadas fuera de la célula, como la insulina, el plegamiento se estabiliza por medio de los enlaces covalentes disulfuro que se forman entre dos cisteínas. En muchas proteínas se encuentra una combinación de hélices α y plegamientos β, que forman estructuras compactas denominadas dominios, unidas por tramos de aminoácidos sin una estructura definida, y que a menudo están relacionados con funciones específicas.
El siguiente nivel de organización es la estructura cuaternaria, en la que dos o más subunidades proteicas se ensamblan mediante las mismas interacciones que mantienen la estructura terciaria: puentes de hidrogeno, enlaces iónicos, interacciones hidrofóbicas y enlaces disulfuro. La hemoglobina integrada por dos cadenas α y dos cadenas β es un ejemplo de estructura cuaternaria. Existen además complejos multiproteícos enzimáticos, que se forman por la unión de dos o más proteínas y están relacionados con reacciones químicas que deben ir en secuencia.
La diversidad de grupos laterales (polares y no polares) que tienen los aminoácidos, permite que las proteínas se unan con todo tipo de moléculas presentes en las células. La interacción provoca cambios en la conformación de las proteínas, hecho que explica las múltiples funciones que realizan.
De la misma manera, las enzimas o catalizadores (todas proteínas, con excepción de las ribozimas), que aumentan la velocidad de las reacciones del metabolismo, se acoplan con las moléculas sobre las cuales actúan, formando un complejo temporal denominado enzima-sustrato. La unión de las enzimas con su sustrato se hace en la región de la enzima denominada sitio activo, que es específico para cada tipo de molécula que debe interactuar con la enzima.
El papel del sitio activo es el de orientar al o a los sustratos, por ejemplo, para romper un enlace químico o para formar uno nuevo; para adicionar un grupo químico, por ejemplo un fosfato, o bien, para cambiar la disposición de sus enlaces. La orientación de los sustratos permite el alineamiento de los grupos químicos que reaccionaran, lo cual reduce la barrera energética que los reactantes deben superar para que la reacción se verifique.
La interacción de la enzima con su o sus sustratos (que en un tiempo se considero similar a la interacción de una llave con su cerradura) en realidad es muy dinámica, pues las conformaciones del sitio activo y de los sustratos se modifican cuando se ponen en contacto; a esta interrelación se le denomina adecuación inducida. La distorsión del sustrato permite que se alcance el llamado estado de transición, durante el cual pueden efectuarse las modificaciones en los enlaces químicos que favorezcan la formación de un nuevo producto.
Las enzimas, en muchas ocasiones, se encuentran unidas fuertemente a otras moléculas o iones que les auxilian en su actividad catalítica. Estos compuestos son los grupos prostéticos como el hemo de la hemoglobina y de la mioglobina, que es la porción de la enzima que se une al oxigeno, para que este pueda ser transportado a las células. Otras veces son los iones, como el zinc o el magnesio, los que, unidos a la enzima, coadyuvan en la formación de nuevos productos.
Existen también las llamadas coenzimas, que son moléculas orgánicas unidas temporalmente a las enzimas y cuya función es la de servir como acarreadores de numerosos grupos químicos; por ejemplo, los nucleótidos NAD+ y FAD+, que son transportadores de electrones en las reacciones de oxido reducción, o la coenzima A, que es un transportador de grupos acetilo, necesarios para que se efectué el ciclo de Krebs. Muchas de las coenzimas son sustancias que no pueden ser sintetizadas por algunos organismos, especialmente los mamíferos. Los precursores de algunas coenzimas son las vitaminas del complejo B; por esta razón estas sustancias son tan importantes en el metabolismo.
Las enzimas, al igual que el resto de las proteínas son muy sensibles a los cambios de temperatura. Funcionan dentro de ciertos límites de temperatura; un aumento de esta aumenta la probabilidad de que las enzimas y los sustratos choquen propiciando su unión. Sin embargo, un aumento mayor de temperatura provoca su desnaturalización, principalmente por el rompimiento de sus puentes de hidrogeno.
Los límites de temperatura que toleran las enzimas son muy variables, dependiendo del organismo de que se trate. Así, en los humanos, la velocidad de reacción alcanza su máximo a 36.5°C, que es la temperatura normal del cuerpo.
La presencia de aminoácidos cargados eléctricamente hace que las enzimas muestren también gran sensibilidad ante los cambios en el pH, es decir, en la concentración de hidrogeniones. Si en el sitio activo de una enzima, los grupos laterales de los aminoácidos están cargados negativamente para realizar su función, un aumento de protones en el medio (disminución del pH) neutralizara las cargas negativas, inhibiendo la actividad enzimática.